(Contacts: Fannie Alloin, Renaud Bouchet, Jean-Claude Leprêtre)
D'un point de vue théorique, le couple Li/S possède l'une des densités d'énergie les plus élevées de tous les systèmes réversibles de stockage chimique de l'énergie (1675 Ah/kg). Lors de la décharge, le soufre forme des polysulfures dont la plupart sont solubles et peuvent agir comme une navette redox induisant une forte autodécharge.
De nombreux travaux ont été menés ces dernières années par l’équipe sur cette thématique en collaboration avec le CEA-LITEN, essentiellement sur la compréhension du système Li/S et l’utilisation de Li2S comme électrode positive. Les résultats les plus marquants obtenus sont :
- L’analyse de la nature des polysulfures obtenus lors de la décharge de l'accumulateur, par spectroscopie UV-visible, chromatographie en phase liquide et résonnance paramagnétique électronique ont permis de décrire précisément la composition en polysulfures de l'électrolyte en fonction de l'état de décharge.
- Les études menées sur des solvants plus ou moins solvatants montrent l'importance de la solvatation des polysulfures de lithium, régissant leur solubilité, sur la capacité de l'accumulateur. Un électrolyte peu dissociant limite grandement la capacité du système.
- L’étude quantitative des différents signaux de diffraction (S8, Li2S) lors du cyclage d’une cellule nous a permis d’obtenir une bonne description des phénomènes mis en jeu.
D'un point de vue théorique, le couple Li/S possède l'une des densités d'énergie les plus élevées de tous les systèmes réversibles de stockage chimique de l'énergie (1675 Ah/kg). Lors de la décharge, le soufre forme des polysulfures dont la plupart sont solubles et peuvent agir comme une navette redox induisant une forte autodécharge.
De nombreux travaux ont été menés ces dernières années par l’équipe sur cette thématique en collaboration avec le CEA-LITEN, essentiellement sur la compréhension du système Li/S et l’utilisation de Li2S comme électrode positive. Les résultats les plus marquants obtenus sont :
- L’analyse de la nature des polysulfures obtenus lors de la décharge de l'accumulateur, par spectroscopie UV-visible, chromatographie en phase liquide et résonnance paramagnétique électronique ont permis de décrire précisément la composition en polysulfures de l'électrolyte en fonction de l'état de décharge.
- Les études menées sur des solvants plus ou moins solvatants montrent l'importance de la solvatation des polysulfures de lithium, régissant leur solubilité, sur la capacité de l'accumulateur. Un électrolyte peu dissociant limite grandement la capacité du système.
- L’étude quantitative des différents signaux de diffraction (S8, Li2S) lors du cyclage d’une cellule nous a permis d’obtenir une bonne description des phénomènes mis en jeu.
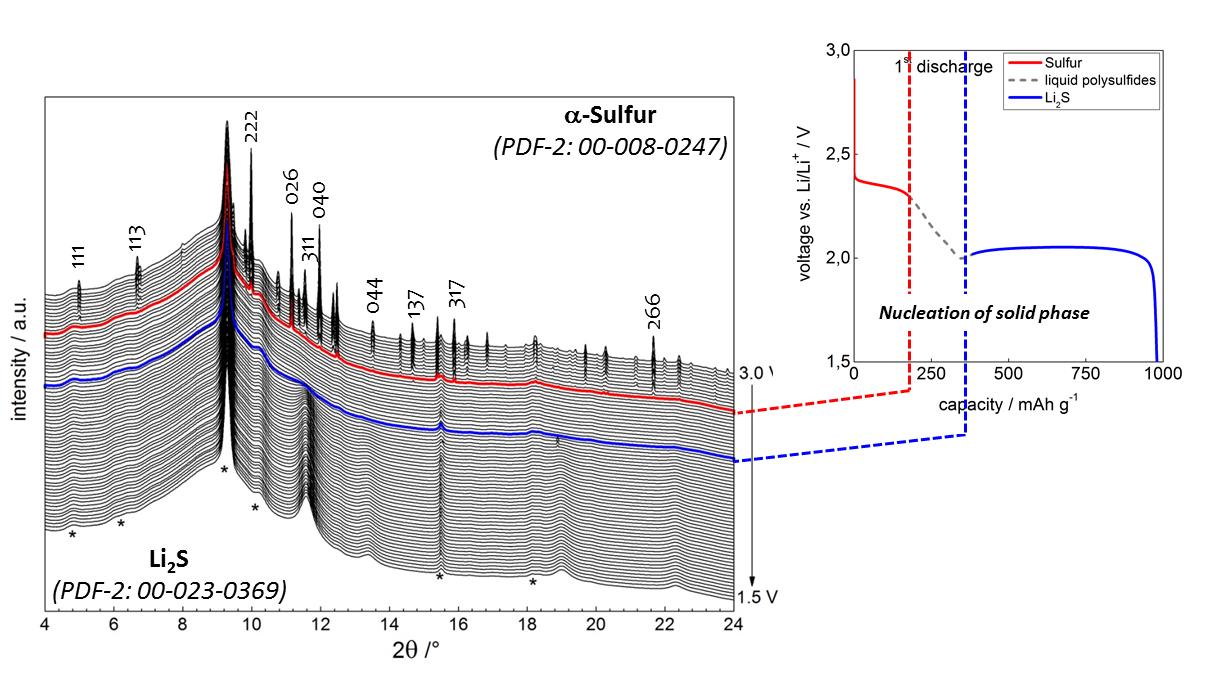
Spectres DRX de l’électrode positive de soufre au cours du cyclage.
- L'étude par spectroscopie d'impédance en fonction de l’état de charge du système Li/S nous a également permis de décrire avec pertinence le système au cours du cyclage.



