Contact: Eric Sibert
La réactivité en catalyse hétérogène et en particulier en électrocatalyse est très sensible à la structure de surface. Pour relier la réactivité à la structure de surface, il est indispensable de travailler sur des surfaces bien définies à l'échelle atomique. Les électrodes monocristallines, pour lesquelles une seule orientation peut être mise en contact avec l'électrolyte, représentent un catalyseur modèle très intéressant pour l'étude de l'influence de l'orientation cristallographique sur l'activité catalytique. Notre équipe possède une longue expérience dans ce domaine. Les surfaces peuvent être utilisées telles quelles ou modifiées par le dépôt d'autres métaux pour obtenir de nouvelles activités. D'ailleurs, nous étudions également les mécanismes de modification eux-mêmes, que nous réalisons par voie électrochimique.
Récemment, nous avons étudié l'activité des surfaces monocristallines d'irridium pour le dégagement d'oxygène (OER : oxygen evolution reaction). En collaboration avec la Norway University of Science and Technology, nous avons réalisé des mesures de spectroscopie d'impédance électrochimique classique et dynamique (EIS:electrochemical impedance spectroscopy et DEIS : dynamic electrochemical impedance spectroscopy) au début du dégagement d'oxygène. Dans ces conditions, la surface d'irridium subit des changements structurels (apparition de défauts de surface, bombements et rugosification de la surface) et chimiques (oxydation et dissolution de surface). La présence de bulles d'oxygène qui se forment et se détachent ajoute une autre difficulté aux mesures EIS. Grâce à l'impédance dynamique, une image plus précise des phénomènes se produisant à l'interface électrode-électrolyte Ir(111) a été obtenue. Seul l'impédance dynamique s'est avéré capable de capter les changements de surface de l'irridum pendant l'OER tout en limitant les changements structurels et chimiques se produisant aux potentiels élevés correspondants. Plus de détails.
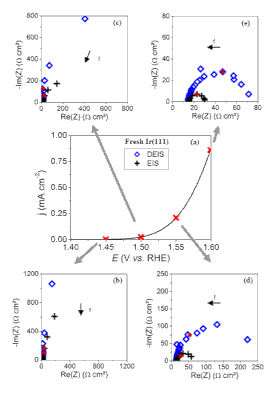
Figure 1: Spectroscopie d'impédance électrochimique dynamique sur Ir(111) dans 0.05 M H2SO4
Sur les surfaces Pt(111) modifiées par dépôt de Pd, nous avons étudié l'activité pour l'électro-oxydation de NaBH4 pour plusieurs épaisseurs de Pd. Toutes les surfaces PdxML/Pt(111) sont plus actives pour l'oxydation de NaBH4 que Pt(111) en dessous de 0,6 V vs. RHE. La surface la plus active est Pd1ML/Pt(111) suivie par les épaisseurs supérieures PdxML/Pt(111). Ainsi, les causes les plus probables pour expliquer l'activité supérieure des surfaces de Pd par rapport à celles de Pt peuvent être de trois ordres : (i) l'oxophilie plus grande du Pd par rapport au Pt facilite l'élimination des intermédiaires BHad fortement adsorbés suivant le mécanisme bien connu de Langmuir-Hinshelwood ; (ii) l'hydrolyse hétérogène de BH4 est orientée vers la dissociation partielle en espèces BH3 pouvant être oxydées plus rapidement que leurs équivalents BHad ; (iii) le dégagement de H2 plus lent au niveau des atomes de Pd que ceux de Pt, Pd demeurant toujours efficace pour oxyder les espèces Had et BHx,ad formées pendant l'adsorption dissociative de BH4. Plus de détails.
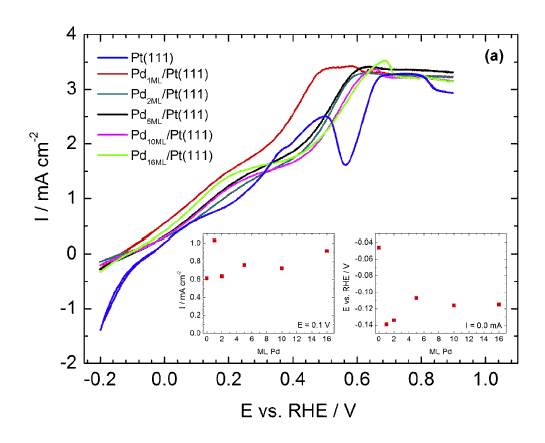
Figure 2 : Voltampérométrie de Pt(111) et PdxML/Pt(111), 20 mVs-1, dans NaOH 0.1 M + NaBH4 0.001 M, en configuration HMRDE à 400 rpm.
Concernant les dépôts électrochimiques, l'essentiel du travail est réalisé en recourant à la diffraction de surface. Plus de détails.
La réactivité en catalyse hétérogène et en particulier en électrocatalyse est très sensible à la structure de surface. Pour relier la réactivité à la structure de surface, il est indispensable de travailler sur des surfaces bien définies à l'échelle atomique. Les électrodes monocristallines, pour lesquelles une seule orientation peut être mise en contact avec l'électrolyte, représentent un catalyseur modèle très intéressant pour l'étude de l'influence de l'orientation cristallographique sur l'activité catalytique. Notre équipe possède une longue expérience dans ce domaine. Les surfaces peuvent être utilisées telles quelles ou modifiées par le dépôt d'autres métaux pour obtenir de nouvelles activités. D'ailleurs, nous étudions également les mécanismes de modification eux-mêmes, que nous réalisons par voie électrochimique.
Récemment, nous avons étudié l'activité des surfaces monocristallines d'irridium pour le dégagement d'oxygène (OER : oxygen evolution reaction). En collaboration avec la Norway University of Science and Technology, nous avons réalisé des mesures de spectroscopie d'impédance électrochimique classique et dynamique (EIS:electrochemical impedance spectroscopy et DEIS : dynamic electrochemical impedance spectroscopy) au début du dégagement d'oxygène. Dans ces conditions, la surface d'irridium subit des changements structurels (apparition de défauts de surface, bombements et rugosification de la surface) et chimiques (oxydation et dissolution de surface). La présence de bulles d'oxygène qui se forment et se détachent ajoute une autre difficulté aux mesures EIS. Grâce à l'impédance dynamique, une image plus précise des phénomènes se produisant à l'interface électrode-électrolyte Ir(111) a été obtenue. Seul l'impédance dynamique s'est avéré capable de capter les changements de surface de l'irridum pendant l'OER tout en limitant les changements structurels et chimiques se produisant aux potentiels élevés correspondants. Plus de détails.

Figure 1: Spectroscopie d'impédance électrochimique dynamique sur Ir(111) dans 0.05 M H2SO4
Sur les surfaces Pt(111) modifiées par dépôt de Pd, nous avons étudié l'activité pour l'électro-oxydation de NaBH4 pour plusieurs épaisseurs de Pd. Toutes les surfaces PdxML/Pt(111) sont plus actives pour l'oxydation de NaBH4 que Pt(111) en dessous de 0,6 V vs. RHE. La surface la plus active est Pd1ML/Pt(111) suivie par les épaisseurs supérieures PdxML/Pt(111). Ainsi, les causes les plus probables pour expliquer l'activité supérieure des surfaces de Pd par rapport à celles de Pt peuvent être de trois ordres : (i) l'oxophilie plus grande du Pd par rapport au Pt facilite l'élimination des intermédiaires BHad fortement adsorbés suivant le mécanisme bien connu de Langmuir-Hinshelwood ; (ii) l'hydrolyse hétérogène de BH4 est orientée vers la dissociation partielle en espèces BH3 pouvant être oxydées plus rapidement que leurs équivalents BHad ; (iii) le dégagement de H2 plus lent au niveau des atomes de Pd que ceux de Pt, Pd demeurant toujours efficace pour oxyder les espèces Had et BHx,ad formées pendant l'adsorption dissociative de BH4. Plus de détails.

Figure 2 : Voltampérométrie de Pt(111) et PdxML/Pt(111), 20 mVs-1, dans NaOH 0.1 M + NaBH4 0.001 M, en configuration HMRDE à 400 rpm.
Concernant les dépôts électrochimiques, l'essentiel du travail est réalisé en recourant à la diffraction de surface. Plus de détails.



